Precyzyjne oznaczenia ilościowe i półilościowe
Zalety testu EUROIMMUN ELISA
Testy immunoenzymatyczne (ELISA) firmy EUROIMMUN wykorzystują polistyrenowe płytki z 96 dołkami pokryte antygenami (lub przeciwciałami) jako fazę stałą, do której wiążą się specyficzne przeciwciała (lub antygeny) obecne w próbkach pacjentów, wykrywane następnie poprzez enzymatyczną reakcję barwną. Wykonanie testu może być manualne, półautomatyczne lub w pełni zautomatyzowane. Monospecyficzne testy ELISA służą do półilościowego lub ilościowego oznaczania przeciwciał lub antygenów. Półilościowe wykrywanie różnych przeciwciał na pojedynczym pasku mikropłytek uzyskuje się za pomocą profilowych testów ELISA. W tym przypadku faza stała jest pokryta mieszaniną antygenów. Przeciwciała można wykrywać półilościowo. Następnie należy przeprowadzić zróżnicowaną detekcję za pomocą odpowiedniego testu monoswoistego.

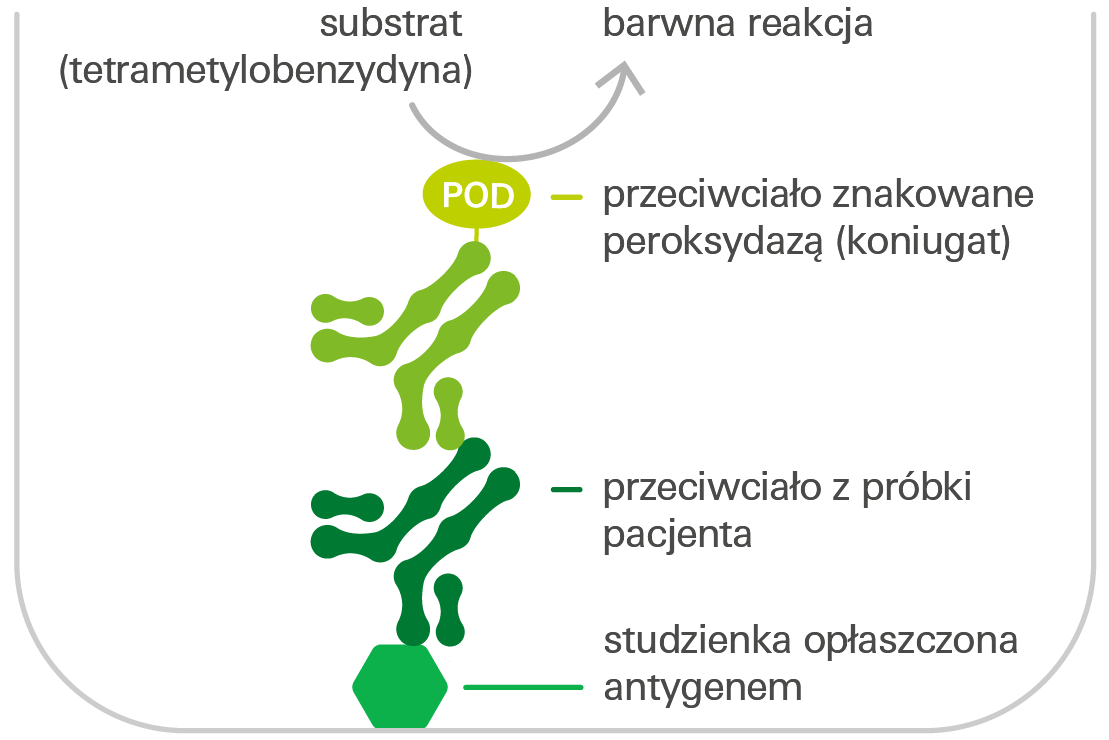
Wykrywanie przeciwciał metodą ELISA
Pokryte antygenem dołki reakcyjne mikropłytki inkubuje się z rozcieńczonymi próbkami pacjentów. Jeśli próbka zawiera specyficzne przeciwciała skierowane przeciwko antygenowi, wiążą się one z antygenem opłaszczającym studzienki reakcyjne. W kolejnym etapie dodaje się znakowane peroksydazą przeciwciało (koniugat), które łączy się ze specyficznymi przeciwciałami. Po dodaniu substratu peroksydazy, tetrametylobenzydyny (TMB), peroksydaza katalizuje reakcję barwną. Intensywność otrzymanego barwnego roztworu jest proporcjonalna do stężenia przeciwciał w próbkach pacjentów. Można to przeliczyć na stężenie za pomocą krzywej kalibracyjnej w testach ilościowych i na wartość stosunku w testach półilościowych.
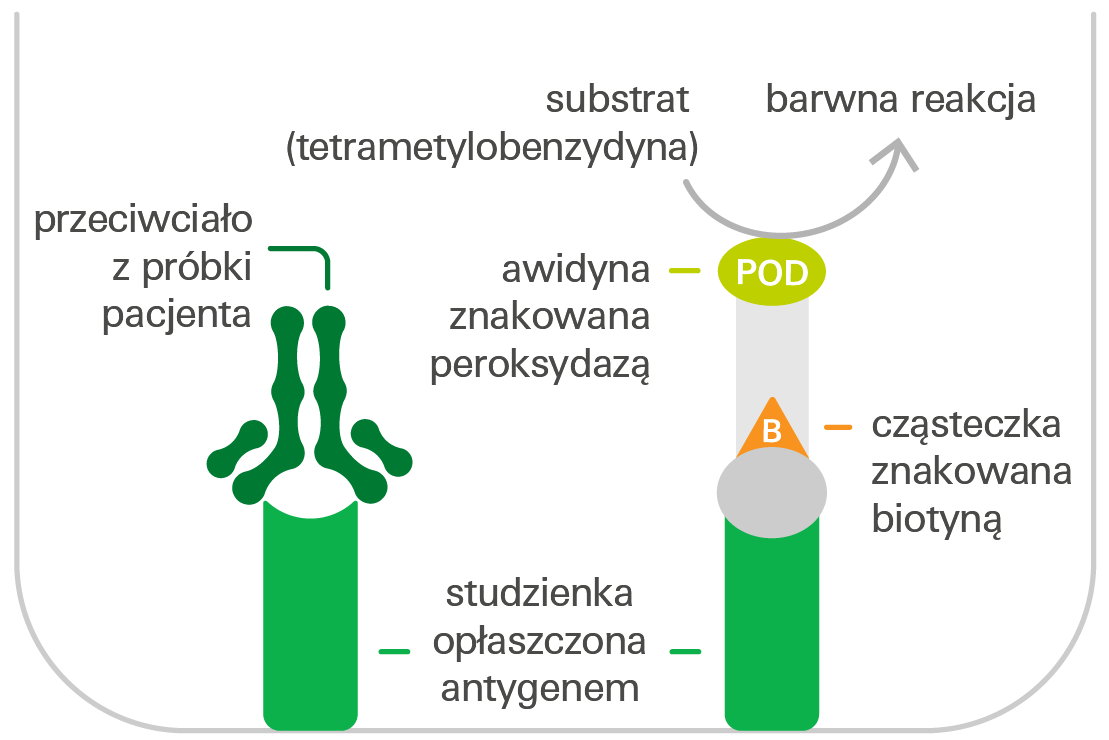
Wykrywanie przeciwciał metodą ELISA (kompetycyjny test ELISA)
Pokryte antygenem dołki reakcyjne mikropłytki inkubuje się z rozcieńczonymi próbkami pacjentów. Jeśli próbka zawiera specyficzne przeciwciała skierowane przeciwko antygenowi, wiążą się one z antygenem opłaszczającym studzienki reakcyjne, gdzie hamują wiązanie znakowanej biotyną cząsteczki, która jest dodawana do studzienki reakcyjnej w kolejnym etapie. Następnie dodaje się znakowaną peroksydazą awidynę, która wiąże się z cząsteczkami znakowanymi biotyną. W trzecim etapie inkubacji peroksydaza i substrat peroksydazy, tetrametylobenzydyna (TMB), katalizują reakcję barwną. Intensywność otrzymanego barwnego roztworu jest odwrotnie proporcjonalna do stężenia przeciwciał w próbce pacjenta i może być przeliczona na stężenie za pomocą krzywej kalibracyjnej w testach ilościowych.
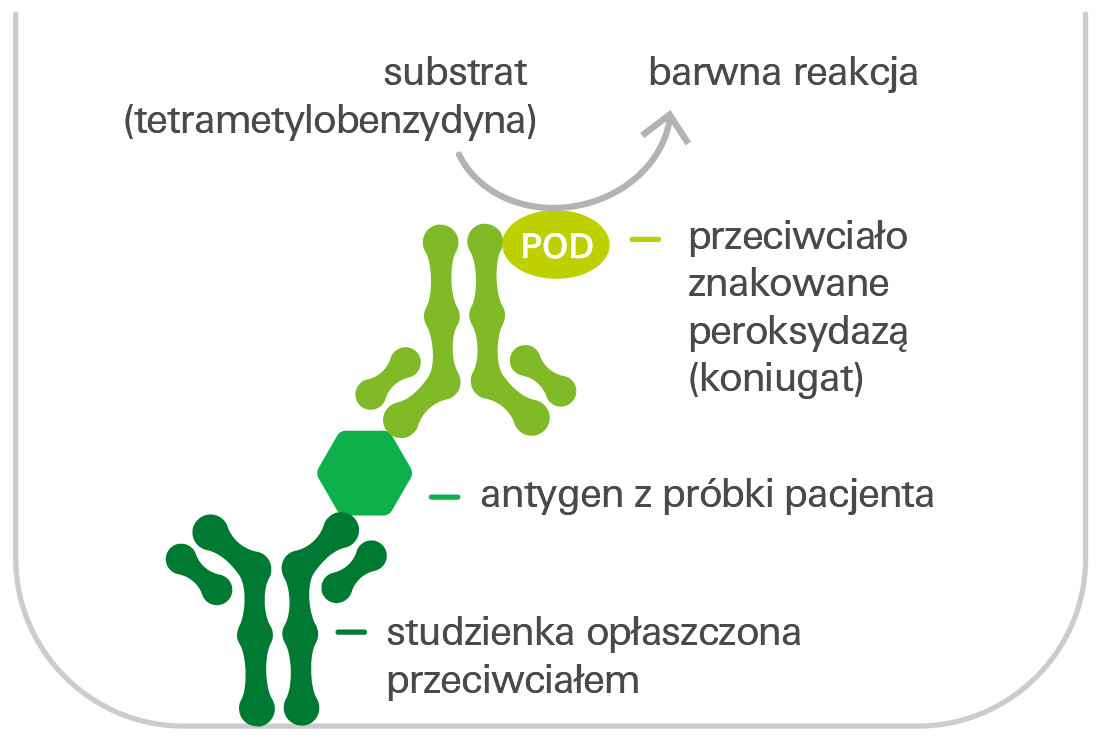
Wykrywanie antygenu metodą ELISA (test kanapkowy ELISA)
Studzienki reakcyjne mikropłytki opłaszczone monoswoistymi przeciwciałami inkubuje się z rozcieńczonymi próbkami pacjentów. Jeśli próbka zawiera badane antygeny, wiążą się one z przeciwciałami opłaszczającymi studzienki reakcyjne. W kolejnym etapie dodaje się znakowane peroksydazą przeciwciało (koniugat), które wiąże się z innym epitopem antygenu. Po dodaniu substratu peroksydazy, tetrametylobenzydyny (TMB), peroksydaza katalizuje reakcję barwną. Intensywność otrzymanego roztworu barwnego jest proporcjonalna do stężenia antygenu w próbce pacjenta i może być przeliczona na stężenie za pomocą krzywej kalibracyjnej w testach ilościowych.
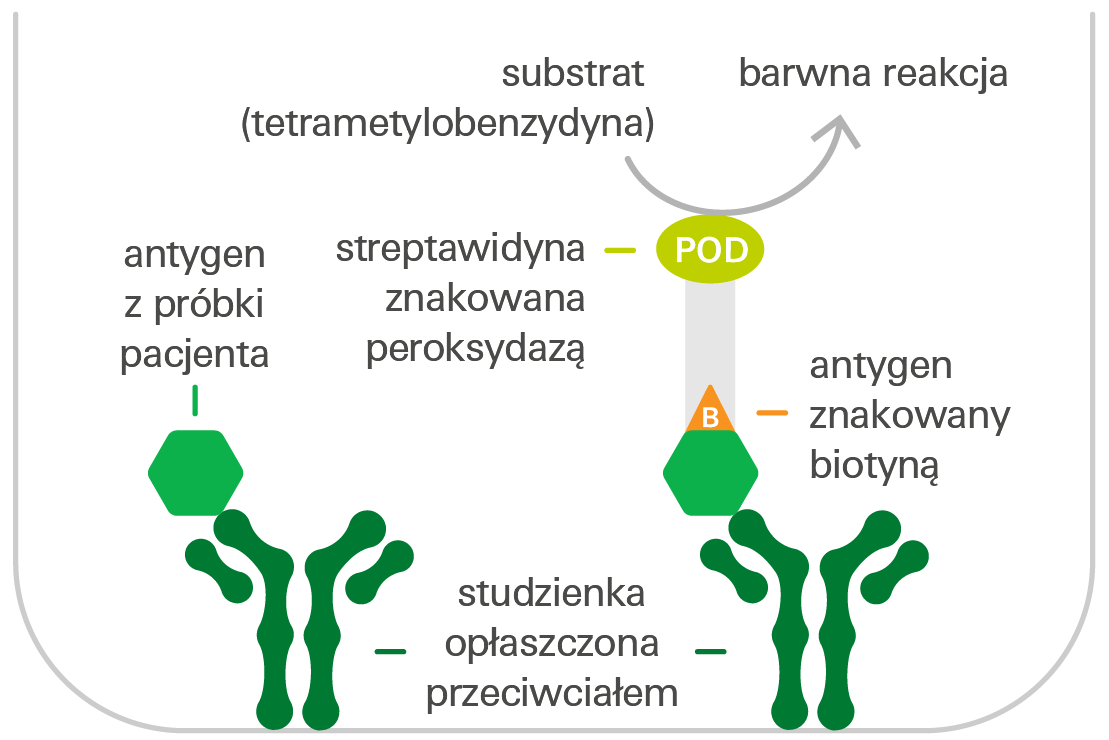
Wykrywanie antygenu metodą ELISA (kompetycyjny test ELISA)
Studzienki reakcyjne mikropłytki opłaszczone monoswoistymi przeciwciałami inkubuje się z rozcieńczonymi próbkami pacjentów i określoną ilością antygenu znakowanego biotyną. Jeśli próbka zawiera odpowiednie antygeny, współzawodniczą one z antygenem znakowanym biotyną o miejsca wiązania w studzience reakcyjnej pokrytej przeciwciałem. Następnie dodaje się znakowaną peroksydazą streptawidynę (koniugat), która wiąże się z antygenami znakowanymi biotyną. Po dodaniu substratu peroksydazy, tetrametylobenzydyny (TMB), peroksydaza katalizuje reakcję barwną. Intensywność otrzymanego roztworu barwnego jest odwrotnie proporcjonalna do stężenia antygenu w próbce pacjenta i może być przeliczona na stężenie za pomocą krzywej kalibracyjnej w testach ilościowych.