Miastenia gravis (łac. myasthenia gravis, MG) jest klasycznym przykładem choroby autoimmunizacyjnej, w której diagnostyka laboratoryjna ma bezpośredni wpływ na szybkość rozpoznania, prawidłową kwalifikację kliniczną oraz dalsze decyzje terapeutyczne. W 2025 roku neurolodzy zrzeszeni w Association of British Neurologists (ABN) opublikowali zaktualizowane zalecenia dotyczące postępowania w przypadku pacjentów z miastenią [1]. W dokumencie tym szczególny nacisk położono na rolę badań serologicznych i – co kluczowe – zastosowania wysokoczułych metod, m.in. typu cell-based assay (CBA).
Jak badać przeciwciała w miastenii gravis
Zalecenia ABN 2025 przedstawiają diagnostykę serologiczną MG jako proces, który powinien rozpoczynać się od oznaczenia przeciwciał o największym znaczeniu klinicznym i największej częstości występowania, a następnie – w razie potrzeby – być rozszerzany o kolejne markery serologiczne.
Pierwszym i podstawowym badaniem jest oznaczenie autoprzeciwciał przeciwko receptorowi acetylocholinowemu (ang. acetylcholine receptor, AChR). ABN rekomenduje, aby właśnie te przeciwciała stanowiły pierwszy krok diagnostyczny u pacjenta z podejrzeniem MG. W wytycznych podkreślono, że techniki radioimmunologiczne (ang. radioimmunoassay, RIA) oraz testy komórkowe CBA charakteryzują się wyższą czułością i swoistością w porównaniu z metodami immunoenzymatycznymi (ang. enzyme-linked immunosorbent assay, ELISA). Wskazano, że metody RIA i CBA powinny być stosowane, jeśli tylko jest to możliwe w praktyce laboratoryjnej [1].
W przypadku ujemnego wyniku badania anty-AChR (AChRAb) kolejnym zalecanym krokiem jest oznaczenie autoprzeciwciał przeciw białku MuSK (ang. muscle-specific kinase antibodies). Autorzy zaleceń zwracają uwagę, że w praktyce w wielu laboratoriach badania pod kątem anty-AChR i anty-MuSK wykonywane są równolegle za pomocą testów CBA [1].
Co badać, gdy „standardowa” serologia jest ujemna
Kolejnym istotnym elementem zaleceń ABN są rekomendacje dotyczące sytuacji diagnostycznie trudnych – gdy zarówno wynik w kierunku przeciwciał anty-AChR, jak i anty-MuSK są ujemne, a podejrzenie miastenii pozostaje wysokie. W takich przypadkach ujemny wynik „standardowej” serologii nie powinien kończyć diagnostyki.
ABN jednoznacznie podkreśla, że wówczas zalecane jest przekazanie surowicy pobranej od pacjenta do wyspecjalizowanego laboratorium neuroimmunologicznego w celu wykonania rozszerzonego panelu badań autoprzeciwciał z wykorzystaniem wysokoczułych metod, w tym testów CBA [1].
Zalecenia precyzują, jakie badania powinien obejmować taki panel. Należą do nich testy oparte na:
- klastrowanych antygenach AChR,
- klastrowanych antygenach MuSK,
oraz testy w kierunku przeciwciał przeciw białku LRP4 (ang. lipoprotein receptor-related protein 4).
Takie podejście pozwala objąć diagnostyką nie tylko autoprzeciwciała najczęściej wykrywane w MG, ale również te, które mogą mieć znaczenie u pacjentów określanych dotychczas jako seronegatywni.
Dlaczego klastrowane antygeny mają znaczenie
Klastrowany (ang. clustered) antygen oznacza, że jest on prezentowany w teście w formie zgrupowanej na powierzchni komórki, a nie jako pojedyncze, rozproszone cząsteczki. W testach typu CBA komórki są przygotowane w taki sposób, aby na ich błonie receptory – np. AChR – występowały w układzie bardziej zbliżonym do naturalnego, obserwowanego w złączu nerwowo-mięśniowym. Najczęściej uzyskuje się to dzięki współekspresji białka rapsyny, które odpowiada za agregację receptorów AChR w skupiska [2]. Taka prezentacja antygenu zwiększa szansę wykrycia autoprzeciwciał rozpoznających epitopy konformacyjne.
ABN podkreśla przy tym niezwykle istotną zasadę interpretacyjną: rozpoznanie miastenii seronegatywnej (seronegative myasthenia gravis, SNMG) należy ustalać dopiero po wykonaniu pełnego zestawu badań, obejmującego również diagnostykę z wykorzystaniem testów CBA [1]. Pacjent nie powinien być określany jako seronegatywny wyłącznie na podstawie ujemnych wyników badań opartych na mniej czułych technologiach lub wykonywanych w ograniczonym panelu.
Czy testy CBA mogą stać się nowym standardem w miastenii
Testy komórkowe typu CBA umożliwiają wykrywanie autoprzeciwciał w warunkach, w których antygen docelowy zachowuje swoją strukturę przestrzenną oraz naturalne osadzenie w błonie komórkowej. Ma to szczególne znaczenie w diagnostyce miastenii, ponieważ część autoprzeciwciał rozpoznaje epitopy zależne od konformacji antygenu.
W ostatnich latach coraz więcej danych wskazuje, że testy CBA mogą poprawiać wykrywalność autoprzeciwciał przy zachowaniu wysokiej swoistości. Wyniki wieloośrodkowego badania SCREAM [3] wskazują, że testy oparte na metodzie CBA mogą osiągać wyższą czułość w oznaczaniu przeciwciał anty-AChR w porównaniu z metodami RIA czy ELISA.
Badania wykazały również, że testy CBA umożliwiają wykrycie przeciwciał anty-AChR u części pacjentów, którzy w klasycznych testach RIA pozostają seronegatywni [4]. Otwiera to drogę do ustalenia rozpoznania u osób, które wcześniej pozostawały bez jednoznacznej diagnozy. Coraz więcej danych sugeruje więc, że testy CBA mają realną szansę stać się nowym standardem diagnostycznym w miastenii gravis [3–5].
Diagnostyka miastenii w praktyce – rozwiązania Euroimmun
Nowoczesne podejście do diagnostyki MG wymaga badań spójnych zarówno z potrzebami klinicznymi, jak i z aktualnymi rekomendacjami towarzystw naukowych. Dlatego też w ofercie EUROIMMUN dostępne są rozwiązania umożliwiające kompleksową diagnostykę autoprzeciwciał w MG.
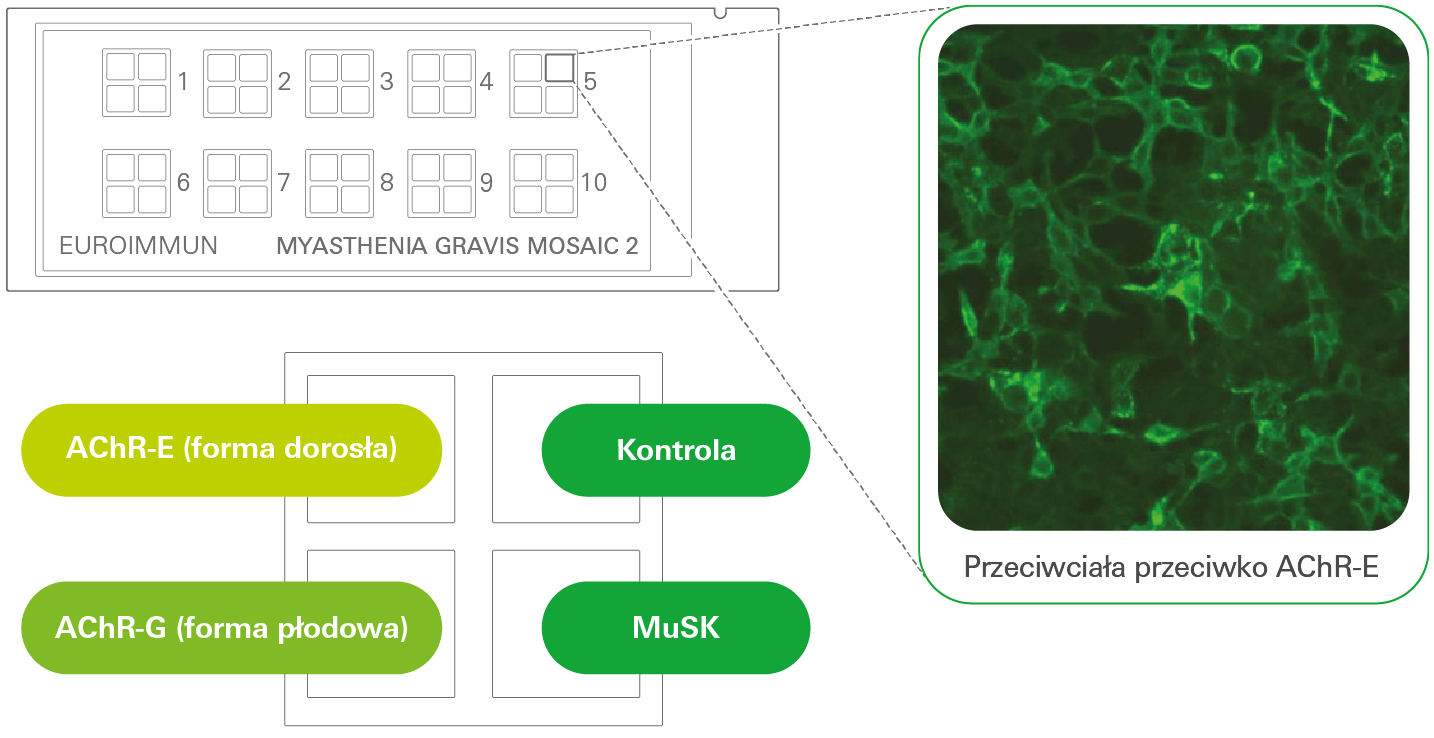
Jednym z nich jest Mozaika CBA Myasthenia gravis 2, która pozwala na jednoczesną ocenę autoprzeciwciał kluczowych w diagnostyce miastenii.
Mozaika Myasthenia gravis 2 to test CBA, zawierający trzy pola z utrwalonymi komórkami transfekowanymi:
- ekspresjonujące postać dorosłą AChR (z podjednostką ε, AChR-E),
- ekspresjonujące postać płodową AChR (z podjednostką γ, AChR-G),
- ekspresjonujące białko MuSK,
oraz komórki typu dzikiego, które w teście pełnią rolę kontroli ujemnej.
Linie komórkowe ekspresjonujące AChR zawierają również rapsynę – cząsteczkę odpowiedzialną za klastrowanie receptorów – co zwiększa czułość wykrywania autoprzeciwciał anty-AChR.
EUROIMMUN oferuje kompleksowy panel testów serologicznych umożliwiających diagnostykę MG, dostosowany do różnych potrzeb klinicznych i badawczych. W ofercie znajdują się testy do oznaczania przeciwciał:
- anty-AChR – test CBA, ELISA,
- anty-MuSK – test CBA, ELISA,
- anty-LRP4 – test ELISA (RUO),
- przeciwko tytynie – test EUROLINE (immunoblot).
Takie podejście może wspierać laboratoria w budowie spójnej i logicznej ścieżki diagnostycznej, zgodnej z aktualnymi trendami i rosnącymi oczekiwaniami klinicznymi.
Podsumowanie
Zaktualizowane zalecenia Association of British Neurologists 2025 stanowią wyraźny sygnał dla praktyki klinicznej i laboratoryjnej: diagnostyka miastenii gravis powinna uwzględniać nie tylko dobór odpowiednich autoprzeciwciał, ale również wybór metody ich oznaczania. Zgodnie z rekomendacjami brytyjskich ekspertów w diagnostyce serologicznej MG zaleca się:
- oznaczanie przeciwciał anty-AChR (metodą RIA lub CBA),
- oznaczanie przeciwciał anty-MuSK (metodą CBA, często równolegle wykonywane z anty-AChR),
- oznaczanie przeciwciał anty-LRP (metodą CBA),
- rozpoznawanie miastenii seronegatywnej dopiero po wykonaniu pełnego zestawu badań, obejmującego również testy CBA.
W świetle tych zaleceń oraz rosnącej liczby danych naukowych testy komórkowe typu CBA przestają być badaniem „uzupełniającym”, a coraz częściej jawią się jako realny kandydat do miana nowego standardu w diagnostyce autoprzeciwciał w miastenii gravis.
- Jacob S. et al. Association of British Neurologists (ABN) autoimmune myasthenia gravis management guidelines (2025 update). Practical Neurology 2025; 25(5): 422–437.
- Diogenes L. et al. Detection of autoantibodies against the acetylcholine receptor, evaluation of commercially available methodologies: fixed cell-based assay, radioimmunoprecipitation assay and enzyme-linked immunosorbent assay. Journal of Neuromuscular Diseases 2024; 11(3): 613–623.
- Li Z., He S., Wang J. et al. A multicentre, prospective, double-blind study comparing the accuracy of autoantibody diagnostic assays in myasthenia gravis: the SCREAM study. Lancet Reg Health West Pac. 2023; 38: 100811.
- Mirian A. et al., Comparison of fixed cell-based assay to radioimmunoprecipitation assay for acetylcholine receptor antibodies detection in myasthenia gravis, J Neurol Sci. 2022; 432: 120084, DOI: 1016/j.jns.2021.120084.
- Spagni G. et al., Comparison of fixed and live cell-based assay for the detection of AChR and MuSK antibodies in myasthenia gravis, Neurol Neuroimmunol Neuroinflamm. 2022; 10(1): e200038, doi: 10.1212/NXI.0000000000200038.
- https://www.euroimmun.pl/miastenia-gravis-kompleksowa-oferta/.
- https://www.euroimmun.pl/myasthenia-gravis-nowy-zloty-standard-w-diagnostyce-autoprzeciwcial/.

Katarzyna Buska-Mach
Kierownik Promocji Produktów i Szkoleń Stacjonarnych / Senior Product Manager ds. Neurologii






