Celiakia, nazywana chorobą trzewną, to przewlekły stan zapalenia jelita cienkiego o podłożu immunologicznym, występujący u osób genetycznie predysponowanych, u których spożycie glutenu prowadzi do uszkodzenia śluzówki jelita i zaniku kosmków jelitowych.
Zgodnie z obowiązującymi rekomendacjami (ESPGHAN, 2012) wymagana jest kilkuetapowa diagnostyka celiakii, na którą składają się: badania serologiczne (przeciwciała: tTG, DPG, EMA), histopatologiczne (biopsja jelita z pobraniem wycinka) i genetyczne (HLA-DQ2 i HLA-DQ8). Ze względu na dziedziczny charakter tej choroby występują grupy ryzyka wymagające monitoringu i badań kontrolnych. Do grupy ryzyka najbardziej zagrożonej chorobą trzewną zalicza się:
- krewnych pierwszego stopnia osób chorych na celiakię, np. matka, ojciec i rodzeństwo
- osoby cierpiące na schorzenia autoimmunologiczne często współistniejące z celiakią, np. cukrzyca typu 1, autoimmunologiczne zapalenie wątroby czy tarczycy, choroba Duhringa
- osoby z chorobami genetycznymi często towarzyszącymi celiakii, np. zespół Downa, Turnera czy Williamsa, niedobór IgA
Osoby z wymienionych powyżej grup odniosą największe korzyści z badań skriningowych w kierunku celiakii. Badanie przesiewowe, podobnie jak diagnostyka celiakii, może składać się z kilku elementów:
- skriningu genetycznego – oznaczenie genów HLA-DQ2 i HLA-DQ8 związanych z predyspozycją do choroby
- skriningu serologicznego – oznaczenie przeciwciał przeciw transglutaminazie tkankowej (anty-tTG)
Europejskie Towarzystwo Gastroenterologii, Hepatologii i Żywienia Dzieci, w skrócie ESPGHAN, rekomenduje u osób zagrożonych celiakią, ale nieposiadających jeszcze objawów choroby, następujący schemat badań przesiewowych:
- Skrining genetyczny w pierwszej kolejności, ponieważ ujemny wynik testu HLA-DQ2/HLA-DQ8 wyklucza ryzyko zachorowania i u osób z takim rezultatem na tym etapie kończy się skrining.
- Skrining serologiczny u osób posiadających przynajmniej jeden gen (HLA-DQ2 lub HLA-DQ8) związany z chorobą. Ten rodzaj skriningu polega na regularnym, powtarzanym raz na 1–2 lata, badaniu poziomu przeciwciał przeciw transglutaminazie tkankowej (anty-tTG IgA lub anty-tTG IgG / anty-DPG IgG u pacjentów z niedoborem IgA).
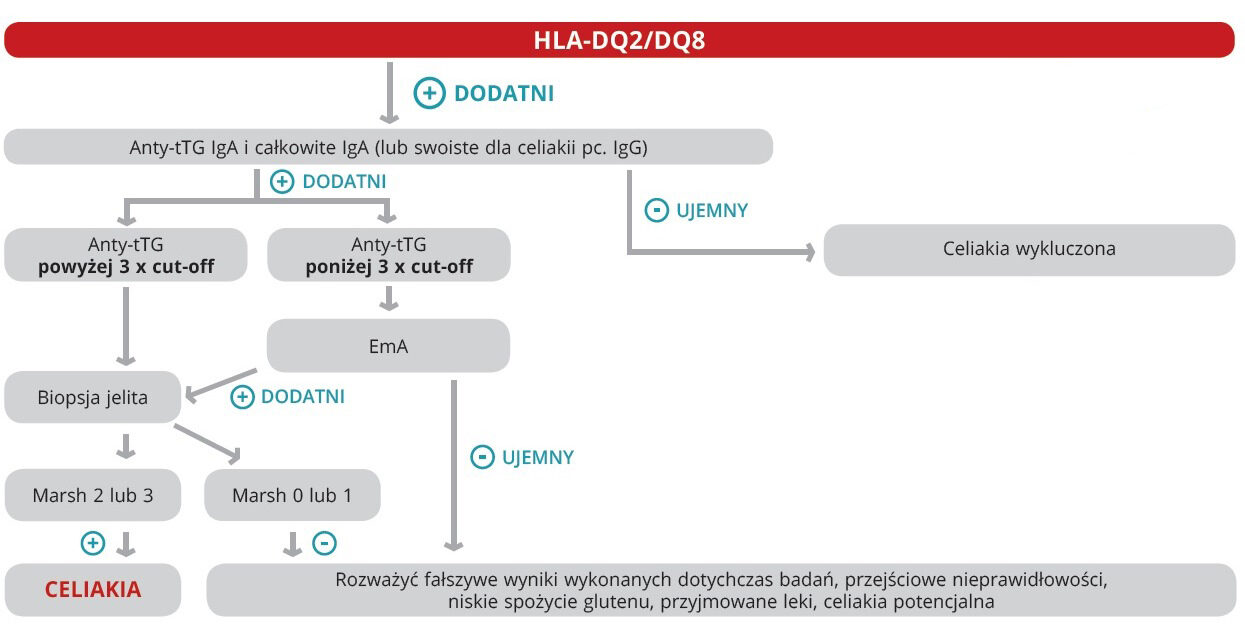
Ujemny wynik skriningu serologicznego wskazuje na brak procesu zapalnego w organizmie prowadzącego do rozwoju celiakii. Jednorazowe badanie serologiczne w kierunku celiakii u osób z grupy ryzyka potwierdzonego genetycznie nie gwarantuje bezpieczeństwa i nie jest jednoznaczne z tym, że u danej osoby w przyszłości nie rozwinie się choroba trzewna. Celiakia może się ujawnić na dowolnym etapie życia. Z tego względu konieczne jest regularne powtarzanie badań serologicznych gwarantujące wykrycie potencjalnej choroby we wczesnym stadium, co zabezpiecza przed szeregiem powikłań. Dodatni wynik skriningu serologicznego jest wskazaniem do konsultacji z gastroenterologiem w celu przeprowadzenia pogłębionej diagnostyki zmierzającej do potwierdzenia rozpoznania celiakii. W ramach pogłębionej diagnostyki stosuje się dodatkowe testy serologiczne wykrywające przeciwciała endomyzjalne (EMA) oraz biopsję jelita cienkiego. Opis wyniku biopsji wskazujący na zmiany w jelicie cienkim 2. lub 3. stopnia w skali Marsha potwierdza rozpoznanie celiakii i jest wskazaniem do leczenia dietą bezglutenową.
Wciąż toczy się dyskusja na temat specjalnych zaleceń dla grupy zagrożonej celiakią, w szczególności krewnych pierwszego stopnia osób chorujących. Dotyczy ona m.in. kwestii wprowadzania glutenu do diety u dzieci pochodzących z rodzin zagrożonych chorobą. Wiadomo, że dzieci posiadające geny HLA-DQ2 i HLA-DQ8 są bardziej narażone na rozwój choroby trzewnej przy wczesnym wprowadzeniu glutenu. ESPGHAN nie sformułował oficjalnych rekomendacji w tym temacie, ale wskazuje na korzyść z wykonania badania genetycznego w kierunku celiakii dzieci, gdyż na postawie dodatniego wyniku można podjąć decyzję np. o opóźnieniu rozszerzenia diety dziecka o gluten. Natomiast po wprowadzeniu glutenu do diety warto stosować skrining serologiczny, by rozpoznać celiakię przed rozwojem poważnych niedoborów żywieniowych.
Skrining serologiczny, z jednej strony umożliwia kwalifikację pacjentów do biopsji jelita, a z drugiej, po potwierdzeniu celiakii i wprowadzeniu diety bezglutenowej, służy do monitorowania leczenia tą dietą. Skrining celiakii wg rekomendacji ESPGHAN należy prowadzić według poniższego schematu:
Piśmiennictwo
- Husby S. et al., European Society for Pediatric Gastroenterology, Hepatology, and Nutrition Guidelines for the diagnosis of celiac disease, „Journal of Pediatric Gastroenterology and Nutrition” 2012; 54 (1): 136–160.
- Megiorni F., Pizzuti A., HLA-DQA1 and HLA-DQB1 in celiac disease predisposition: practical implications of the HLA molecular typing, „Journal of Biomedical Science” 2012; 19: 88.
- Szajewska H., Shamir R., Mearin L. et al., Gluten introduction and the risk of coeliac disease: a position paper by the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition, „Journal of Pediatric Gastroenterology and Nutrition” 2016; 62: 507–513.