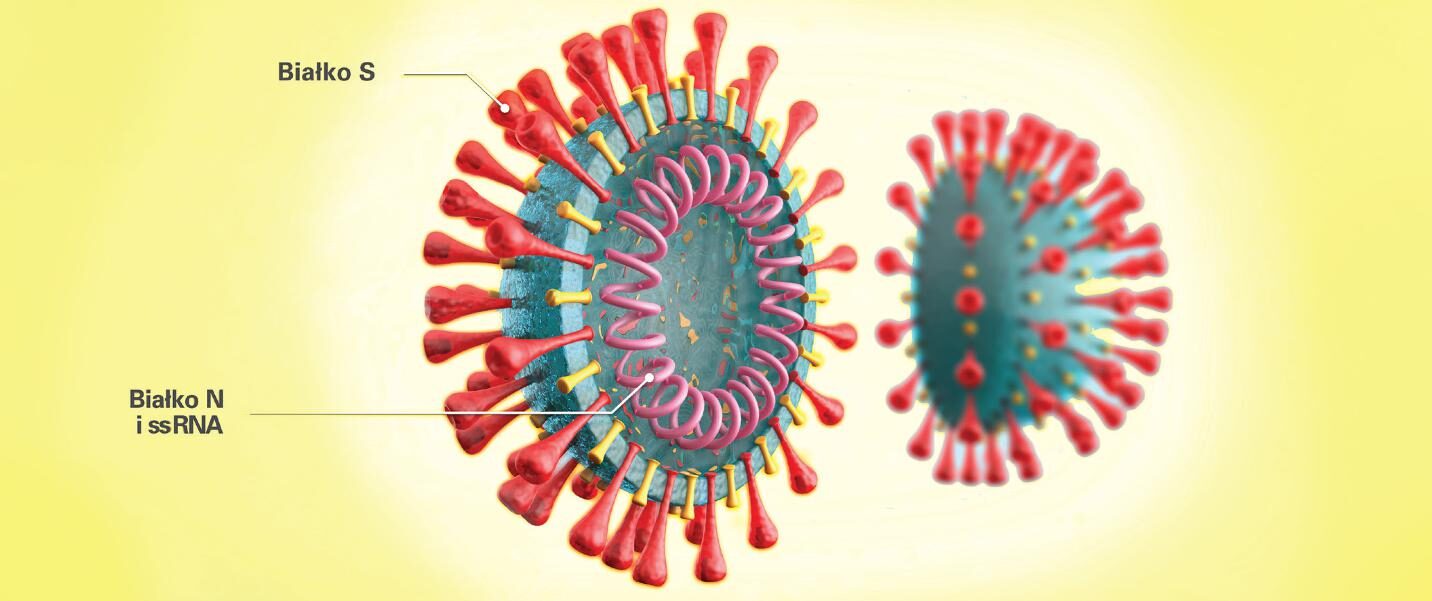
Badania nad odpowiedzią immunologiczną na zakażenie SARS-CoV-2 są obecnie prowadzone w wielu ośrodkach naukowych na świecie. Od momentu pojawienia się nowego koronawirusa pod koniec 2019 roku opublikowano już artykuły na temat specyficznych przeciwciał anty-SARS-CoV-2, ale wiedza dotycząca kinetyki ich powstawania i znaczenia jest wciąż ograniczona. Ze względu na krótki czas trwania pandemii COVID-19 (Coronavirus disease 2019) nie potwierdzono jeszcze ostatecznie, czy specyficzne przeciwciała anty-SARS-CoV-2 w klasie IgG odgrywają w przypadku tej choroby rolę ochronną i czy będą chronić przed reinfekcją w przyszłości. Dopóki nie zostaną przeprowadzone kompleksowe badania naukowe na ten temat, możemy jedynie bazować na ugruntowanej wiedzy na temat działania i funkcji poszczególnych klas przeciwciał w innych, znanych od lat infekcjach.
Rola przeciwciał IgG
- Przeciwciała IgG są elementami pamięci immunologicznej – immunoglobuliny te pełnią więc w przypadku wielu zakażeń funkcję ochronną przed reinfekcją (1).
- Klasa IgG jest szczególnie ważna w walce z mikroorganizmami. W surowicy występuje ona w najwyższym stężeniu, gdzie stanowi około 75% wszystkich immunoglobulin (2).
- W przypadku większości zakażeń podwyższone stężenie przeciwciał klasy IgG koreluje ze zwiększoną odpornością przeciwko patogenowi, wobec którego są skierowane immunoglobuliny. To zjawisko jest obecnie wykorzystywane w przypadku szczepień ochronnych (3). Szczepienia doprowadziły do eradykacji groźnych chorób zakaźnych, takich jak np. ospa prawdziwa. Badanie obecności immunoglobulin klasy IgG jest formą badania skuteczności szczepionek oraz oceny odporności poszczepiennej (4).
Przeciwciała IgG a odporność
Koronawirusy przez lata były uważane za niegroźne dla ludzi wirusy, wywołujące łagodne infekcje dróg oddechowych, które po kilku dniach samoistnie ustępują. Pojawienie się koronawirusów o dużej zjadliwości (SARS-CoV(-1), MERS-CoV) spowodowało wzrost zainteresowania tymi patogenami wśród naukowców. Badania nad SARS-CoV-2 są obecnie w toku, ale w związku z wysokim stopniem podobieństwa wśród koronawirusów wiele projektów badawczych bazuje na analogii COVID-19 do innych zakażeń powodowanych przez SARS-CoV(-1) lub MERS-CoV.
- Sekwencja RNA wirusa SARS-CoV-2 jest aż w 79,6% homologiczna z sekwencją wirusa SARS-CoV(-1) (5). W przypadku SARS specyficzne przeciwciała IgG pojawiały się średnio po 10 dniach od wystąpienia objawów, jednak u niektórych chorych można było je wykryć już po 4 dniach. Ponadto przeciwciała przeciwko SARS-CoV(-1) pojawiały się niemal jednocześnie w trzech klasach IgA, IgG i IgM, co sugeruje, że pojawienie się przeciwciał w klasie IgG mogłoby być wystarczające do wykrycia zakażenia.
- W przypadku infekcji SARS-CoV(-1) dowiedziono, że po 240 dniach od wystąpienia objawów u 100% badanych wykryto przeciwciała klasy IgG (przeciwciała klasy IgM były wtedy obecne już u tylko 36% badanych) (6).
- Mediana dla serokonwersji anty-SARS-CoV-2 w przypadku przeciwciał klas IgA, IgM i IgG wynosi odpowiednio 11, 12, i 14 dni od wystąpienia objawów. Potwierdzono jednak przypadki osób, u których już w pierwszych dniach infekcji wykryto specyficzne przeciwciała. Wskaźnik serokonwersji i poziom specyficznych przeciwciał wzrasta szybko w ciągu pierwszych dwóch tygodni (7). Ponadto wykazano, że specyficzne przeciwciała anty-SARS-CoV-2 klasy IgG utrzymują się przez dłuższy czas na wysokim poziomie, co może sugerować, że pełnią one rolę ochronną (8).
Na podstawie wstępnych badań nad nowym koronawirusem oraz szczegółowych danych na temat odpowiedzi immunologicznej na zakażenia SARS-CoV(-1) można więc przypuszczać, że specyficzne przeciwciała w klasie IgG pozostaną obecne u ozdrowieńców przez dłuższy czas.
Co wiemy o ochronnej roli przeciwciał IgG w COVID-19?
Specyficzne względem wirusów przeciwciała neutralizujące (ang. neutralizing antibodies, nAbs) powstają w odpowiedzi na infekcję (lub szczepienie) i pełnią kluczową rolę w kontrolowaniu infekcji wirusowej (5).
- Obecność nAbs może zapobiegać m.in. łączeniu się wirusa z docelowym receptorem na komórce gospodarza (przez co proces wnikania do komórek jest zaburzony), a także doprowadzić do jego zniszczenia (9).
- Przeciwciała wytworzone w wyniku pierwotnej infekcji mogą pełnić funkcję ochronną w przypadku reinfekcji. Dowiedziono, że po zaszczepieniu makaków preparatem zawierającym inaktywowany wirus SARS-CoV(-1) doszło do wytworzenia przeciwciał neutralizujących (IgG). Wykazano także wyższą zdolność układu immunologicznego do syntezy specyficznych przeciwciał IgG w wyniku kontaktu z wirusem po uprzednim szczepieniu (10).
- W innym badaniu dwukrotnie zakażono makaki SARS-CoV-2. W przypadku kolejnego kontaktu z wirusem (reinfekcji) w wymazach pobranych po 5 dniach od zakażenia nie wykryto genomu wirusa, nie stwierdzono także żadnych patologicznych zmian w obrębie płuc. Wyniki te wskazują, że u ozdrowieńców makaków nie dochodzi do ponownej infekcji tym samym szczepem wirusa SARS-CoV-2 (11).
- U ludzi wysokie stężenia nAbs oraz IgG skierowanych przeciwko SARS-CoV(-1), które obserwowano po 2–3 miesiącach od wystąpienia objawów, sugerują, że pasywna immunizacja przy pomocy osocza lub stężonych przeciwciał od osób, które przebyły chorobę, może być jedną z opcji leczenia SARS (12).
- W leczeniu COVID-19 zaczęto z powodzeniem wykorzystywać przeciwciała anty-SARS-CoV-2 pozyskane od ozdrowieńców (5). Pierwsze badania przeprowadzono na 5 zakażonych SARS-CoV-2 w stanie krytycznym, którym podano przeciwciała pozyskane od ozdrowieńców (IgG w mianie 1:1000, miano neutralizujące > 40), co doprowadziło do szybkiej poprawy stanu ich zdrowia (brak materiału genetycznego wirusa w próbkach pobranych po 12 dniach od podania przeciwciał) (13). W innych badaniach stwierdzono, że w przypadku 10 pacjentów z COVID-19 w stanie ciężkim podanie pojedynczej dawki osocza (200 mL) pobranego od osób, które przeszły infekcję nowym koronawirusem, skracało czas trwania objawów, a nawet prawdopodobnie ratowało życie pacjentów. Wśród pacjentów z grupy kontrolnej, którzy nie otrzymali osocza pobranego od ozdrowieńców, przebieg infekcji był cięższy, a troje chorych zmarło (14).
Przeciwciała anty-SARS-CoV-2 i ich antygen docelowy
- Podjednostka S1 białka S SARS-CoV-2 łączy się z receptorem ACE2 (Angiotensin-Converting Enzyme 2) obecnym na komórkach nabłonka pęcherzyków płucnych, co umożliwia wniknięcie wirusa do komórki docelowej (15). Wydaje się więc, że przeciwciała skierowane przeciwko temu białku mogą pełnić kluczową rolę w odporności na COVID-19. W przypadku SARS-CoV(-1) nAbs skierowane przeciwko domenie S1 mogą przerwać interakcję wirusa z ACE2 (9). W przypadku zakażeń SARS-CoV(-1) ustalono, że specyficzne przeciwciała przeciwko białku S jako jedyne mają właściwości neutralizujące (16).
- Badania nad SARS-CoV-2 wykazały, że nowy koronawirus ma większe powinowactwo do receptora ACE2 w porównaniu do SARS-CoV(-1) i w związku z tym transmisja COVID-19 jest prawdopodobnie łatwiejsza niż w przypadku epidemii SARS, która miała miejsce w 2003 roku.
- Wykazano ścisłą korelację pomiędzy testem EUROIMMUN ELISA Anty-SARS-CoV-2 (IgA, IgG), który jest oparty o antygen S1, a testem neutralizacji PRNT (Plaque Reduction Neutralization Test) (17). Test PRNT uważa się za „złoty standard” pomiaru skuteczności przeciwciał w neutralizowaniu wirusów chorobotwórczych (18).
Pierwsze wyniki badań nad zastosowaniem przeciwciał neutralizujących anty-SARS-CoV-2 w walce z najcięższymi przypadkami COVID-19 są bardzo obiecujące. Ich potwierdzenie w dalszych badaniach mogłoby oznaczać, że po przebytym zakażeniu rozwija się odporność na reinfekcję SARS-CoV-2. Trudno jednak obecnie ocenić, czy specyficzne przeciwciała anty-SARS-CoV-2 w klasie IgG będą pełniły funkcje ochronne przez wiele lat. Na seroprotekcję ma wpływ wiele czynników. Jeśli nowy koronawirus będzie często mutował, powstałe podczas wcześniejszej infekcji przeciwciała mogą być niewystarczające w walce z nowym szczepem SARS-CoV-2.
Piśmiennictwo
- Furst D.E. Serum Immunoglobulins and Risk of Infection: How Low Can You Go? Semin Arthritis Rheum. 2009, 39(1), strony 18–29.
- Napiórkowska-Baran K. i wsp. Oznaczanie przeciwciał w codziennej praktyce. Część I – właściwości przeciwciał. Alergia Astma Immunologia. 2019, 24(2), strony 51–58.
- Logan E. i wsp. Elevated IgG Responses in Infants Are Associated With Reduced Prevalence of Mycobacterium tuberculosis Infection. Front. Immunol. [Online] 02 07 2018. [Zacytowano: 16 04 2020.] https://www.frontiersin.org/articles/10.3389/fimmu.2018.01529/full.
- Caldas I.R. i wsp. (Collaborative group for studies on yellow fever vaccines). Duration of post-vaccination immunity against yellow fever in adults. Vaccine. 2014, 32, strony 4977–4984.
- Jiang S. i wsp. Neutralizing Antibodies against SARS-CoV-2 and Other Human Coronaviruses. Trends in Immunology. [Online] 02 04 2020. [Zacytowano: 16 04 2020.] https://doi.org/10.1016/j.it.2020.03.007.
- Woo P.C.Y. i wsp. Longitudinal Profile of Immunoglobulin G (IgG), IgM, and IgA Antibodies against the Severe Acute Respiratory Syndrome (SARS) Coronavirus Nucleocapsid Protein in Patients with Pneumonia Due to the SARS Coronavirus. Clinical and Diagnostic Laboratory Immunology. 2004, 11(4), strony 665–668.
- Zhao J. i wsp. Antibody responses to SARS-CoV-2 in patients of novel coronavirus. medRxiv (Preprint). [Online] 03 03 2020. [Zacytowano: 16 04 2020.] https://doi.org/10.1101/2020.03.02.20030189.
- Tang Xiao A. i wsp. Profile of Specific Antibodies to SARS-CoV-2: The First Report. Journal of Infection. [Online] 11 03 2020. [Zacytowano: 16 04 2020.] https://doi.org/10.1016/j.jinf.2020.03.012.
- Zhou G., Zhao Q. Perspectives on therapeutic neutralizing antibodies against the Novel Coronavirus SARS-CoV-2. Int. J. Biol. Sci. 2020, 16(10), strony 1718–1723.
- Zhou J. i wsp. Immunogenicity, safety, and protective efficacy of an inactivated SARS-associated coronavirus vaccine in rhesus monkeys. Vaccine. 2005, 23, strony 3202–3209.
- Bao L. i wsp. Reinfection could not occur in SARS-CoV-2 infected rhesus macaques. bioRxiv (Preprint). [Online] 14 03 2020. [Zacytowano: 16 04 2020.] https://doi.org/10.1101/2020.03.13.990226.
- Hsueh P.-R. i wsp. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus. Clin Microbiol Infect. 2004, 10, strony 1062–1066.
- Shen C. i wsp. Treatment of 5 Critically Ill Patients with COVID-19 with Convalescent Plasma. JAMA. [Online] 27 03 2020. [Zacytowano: 16 04 2020.] doi:10.1001/jama.2020.4783.
- Duan K. i wsp. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. PNAS. [Online] 06 04 2020. [Zacytowano: 16 04 2020.] https://www.pnas.org/content/early/2020/04/02/2004168117.
- Hoffmann M. i wsp. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. [Online] 2020. doi: 10.1016/j.cell.2020.02.052.
- Yu S. i wsp. Retrospective Serological Investigation of Severe Acute Respiratory Syndrome Coronavirus Antibodies in Recruits from Mainland China. Clin Diagn Lab Immunol. 2005, 12(4), strony 552–554.
- Okba N.M.A. i wsp. SARS-CoV-2 specific antibody responses in COVID-19 patients. medRxiv (Preprint). [Online] 20 03 2020. [Zacytowano: 16 04 2020.] doi: 10.1101/2020.03.18.20038059.
- Thomas S.J. i wsp. Dengue Plaque Reduction Neutralization Test (PRNT) in Primary and Secondary Dengue Virus Infections: How Alterations in Assay Conditions Impact Performance. The American Journal of Tropical Medicine and Hygiene. 2009, 81(5), strony 825–833.

Barbara Pawłowska
Zastępca Kierownika Działu Informacji Naukowej, Kierownik ds. Szkoleń On-line