Odpowiedź immunologiczna jest niezbędnym elementem w walce organizmu z patogenami. Układ immunologiczny człowieka wykorzystuje w tym celu wiele mechanizmów, w tym odpowiedź humoralną, czyli produkcję przeciwciał, oraz odpowiedź komórkową, która jest głównym tematem tego filmu. Na rynku diagnostycznym dostępne są dwa rodzaje testów służących do badania odpowiedzi komórkowej. Pierwszy z nich opiera się na technologii ELISA i pomiarze ilościowym interferonu gamma wydzielanego przez stymulowane limfocyty. Jest to test uwalniania interferonu gamma, stąd jego inna często stosowana nazwa – IGRA (ang. interferon-gamma-release assay). Drugi natomiast opiera się na technologii ELISPOT, która polega na zliczaniu efektorowych komórek wydzielających interferon gamma. Z filmu dowiesz się więcej o zasadzie działania obu rodzajów testów oraz podobieństwach i różnicach pomiędzy nimi.
00:43 Co to jest odpowiedź komórkowa i na czym polega?
01:31 Jak powstaje odpowiedź komórkowa?
03:02 Jak bada się odpowiedź komórkową?
04:06 Test Quan-T-Cell SARS-CoV-2 (IGRA)
05:44 Test T-SPOT.COVID
07:23 Jakie są różnice między testami Quan-T-Cell i T-SPOT.COVID?
09:06 Dlaczego warto badać odpowiedź komórkową w COVID-19?
10:33 Kompleksowa diagnostyka odpowiedzi immunologicznej na SARS-CoV-2
Co to jest odpowiedź komórkowa i na czym polega?
Za komórkową odpowiedź immunologiczną odpowiedzialne są głównie limfocyty T, a dokładnie limfocyty T pomocnicze oraz limfocyty T cytotoksyczne. Komórki prekursorowe limfocytów T wytwarzane są w szpiku kostnym, następnie dojrzewają głównie w grasicy, skąd migrują do krwi obwodowej oraz narządów limfatycznych. Ilość limfocytów T we krwi obwodowej to nawet kilka bilionów komórek w każdym litrze krwi. Czas życia limfocytów T wynosi od kilku miesięcy do kilku lat, co jest kluczową informacją z punktu widzenia długości trwania komórkowej odpowiedzi immunologicznej.
Jak powstaje odpowiedź komórkowa?
W jaki sposób komórki T reagują na pojawiające się zagrożenie, np. patogeny, takie jak wirus SARS-CoV-2? Limfocyty posiadają swoje receptory, czyli receptory limfocytów T, w skrócie TCR. Są one białkami podobnymi do przeciwciał, czyli zawierają tak zwane regiony stałe i zmienne. Regiony zmienne TCR-ów tworzą miejsce wiązania, które rozpoznaje obce antygeny. Antygen ten jest prezentowany limfocytom T przez odpowiednie białka na powierzchni komórek. Na skutek połączenia się receptora limfocytu T z antygenem, uruchamiany jest szereg reakcji immunologicznych, w efekcie których dochodzi również do produkcji różnych cząsteczek regulatorowych, czyli cytokin, między innymi interferonu gamma. Interferon gamma pojawia się we wczesnych stadiach infekcji – przed antygenowo swoistą adaptacyjną odpowiedzią humoralną.
Omówmy to skrótowo na przykładzie SARS-CoV-2: we krwi pacjenta, który miał kontakt z wirusem SARS-CoV-2 lub był szczepiony przeciw COVID-19, obecne są limfocyty T zdolne do rozpoznawania antygenów tego patogenu, czyli na przykład podjednostki S1 białka S wirusa SARS-CoV-2. Proces ten wiąże się z syntezą i uwalnianiem interferonu gamma, czyli ważnej cząsteczki sygnałowej układu immunologicznego. Oznaczanie interferonu gamma leży zatem u podstawy badania komórkowej odpowiedzi immunologicznej zarówno po przechorowaniu, jak i szczepieniu przeciwko COVID-19.
Jak bada się odpowiedź komórkową?
W warunkach laboratoryjnych odpowiedź immunologiczną zależną od limfocytów T można oceniać między innymi przy pomocy techniki, która polega na pobudzaniu tych komórek specyficznymi antygenami, a następnie detekcji uwalnianego przez nie ex vivo interferonu gamma. Jest to test uwalniania interferonu gamma, stąd jego inna często stosowana nazwa – IGRA. Co ciekawe, tego rodzaju testy są od lat wykorzystywane na przykład w diagnostyce utajonego zakażenia prątkami gruźlicy i stanowią alternatywę dla próby tuberkulinowej.
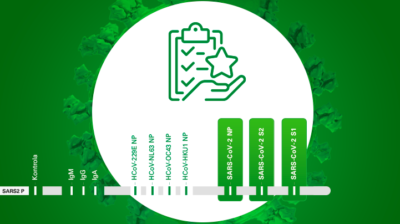
Na rynku diagnostycznym dostępne są dwa rodzaje testów służących do badania wydzielania interferonu przez limfocyty po stymulacji antygenami wirusa SARS-CoV-2. Pierwszy z nich opiera się na technologii ELISA i pomiarze ilościowym interferonu gamma wydzielanego przez stymulowane limfocyty. Drugi natomiast opiera się na technologii ELISpot, która polega na zliczaniu efektorowych komórek wydzielających interferon gamma.
Test Quan-T-Cell ELISA (IGRA)
Przykładem testu typu IGRA w badaniu odpowiedzi komórkowej na SARS-CoV-2 jest test EUROIMMUN Quan-T-Cell ELISA. Badanie to wykonuje się z pełnej krwi pobranej od pacjenta, a sama procedura wykonania jest dwuetapowa.
W pierwszym etapie testu Quan-T-Cell przeprowadza się 24-godzinną stymulację limfocytów T, którą wykonuje się w 3 probówkach. W pierwszej probówce świeżo pobrana krew pełna inkubowana jest z antygenem S1 wirusa SARS-CoV-2 opłaszczonym na dnie probówki testowej. Jeśli limfocyty T miały wcześniejszy kontakt z antygenami wirusa SARS-CoV-2 w organizmie pacjenta, na skutek ich pobudzenia przez antygen S1 w warunkach in vitro dochodzi do wydzielania interferonu gamma.
Krew pełna jest również inkubowana w drugiej probówce z kontrolą ujemną, co umożliwia ocenę nieswoistej odpowiedzi tła, oraz w trzeciej probówce z kontrolą dodatnią służącą do oceny ogólnej odpowiedzi limfocytów T po stymulacji.
W drugim etapie testu Quan-T-Cell wykonuje się badanie ELISA umożliwiające ilościowy pomiar wydzielonego przez limfocyty T interferonu gamma.
Zestaw testowy Quan-T-Cell składa się z dwóch produktów. Pierwszy to zestaw probówek do stymulacji limfocytów T, natomiast drugi to ilościowy test ELISA do pomiaru uwolnionego przez limfocyty T interferonu gamma. Do zalet zestawu do stymulacji limfocytów T zalicza się między innymi brak konieczności izolacji jednojądrzastych komórek krwi obwodowej, czyli w skrócie PBMC. Z kolei zaletą testu ELISA, który wchodzi w skład testu IGRA, jest możliwość pełnej automatyzacji przy pomocy szeroko dostępnych w Polsce urządzeń.
Test T-SPOT.COVID
Drugim dostępnym na rynku testem do badania odpowiedzi komórkowej w COVID-19 jest Test T-SPOT.COVID firmy Oxford Immunotec. Firma EUROIMMUN jest wyłącznym dystrybutorem testu na terenie Polski. Test ten opiera się na technologii ELISpot, która od wielu lat stosowana jest w badaniach diagnostycznych gruźlicy na całym świecie. Metoda ta wykorzystuje naturalny mechanizm wytwarzania przez limfocyty cytokin, w tym interferonu gamma, dzięki czemu po stymulacji in vitro odpowiednimi peptydami specyficznymi dla SARS-CoV-2 możliwa jest detekcja odpowiedzi immunologicznej wygenerowanej na skutek poprzedniego kontaktu z wirusem lub wytworzonej na skutek szczepienia. Test T-SPOT.COVID jest badaniem jakościowym, pozwala na wizualizację pojedynczych komórek produkujących interferon gamma jako „plamek” w studzienkach płytek ELISpot.
W przypadku testu T-SPOT.COVID oznaczenie dzieli się na 4 etapy:
- izolacja jednojądrzastych komórek krwi obwodowej
- stymulacja limfocytów T antygenami specyficznymi dla SARS-CoV-2. W przypadku tego testu mamy do czynienia z antygenami pochodzącymi z białka S oraz N. Komórki, które miały w przeszłości kontakt z wirusem, zaczynają produkcję interferonu gamma
- wyznakowanie wydzielonego interferonu gamma przy wykorzystaniu znakowanych przeciwciał
- jakościowa analiza wydzielonego przez limfocyty T interferonu gamma, czyli mówiąc najprościej: zliczanie powstałych „plamek”. Każda plamka jest wyznacznikiem jednej komórki reagującej na antygeny SARS-CoV-2
Jakie są różnice między testami Quan-T-Cell i T-SPOT.COVID?
Testy Quan-T-Cell oraz T-SPOT.COVID wykazują zarówno podobieństwa, jak i różnice. Oba służą do badania wydzielania interferonu przez limfocyty po stymulacji antygenami wirusa SARS-CoV-2. Oba testy posiadają certyfikaty CE-IVD i mogą być stosowane w laboratoriach rutynowych.
Pierwszą różnicą jest fakt, że w teście Quan-T-Cell stymulacja limfocytów odbywa się wyłącznie za pomocą białka S1 SARS-CoV-2. W teście T-SPOT.COVID stymulujemy limfocyty zarówno antygenami pochodzącymi z białka S, jak i N, co pozwala nam stwierdzić, czy odpowiedź limfocytów T jest spowodowana infekcją czy szczepieniem, gdyż przeciwciała przeciwko białku N powstają wyłącznie po przebyciu infekcji SARS-CoV-2.
W przypadku obu testów materiałem do badania jest krew pełna. Test Quan-T-Cell nie wymaga izolacji PBMC, natomiast test T-SPOT.COVID wymaga etapu izolacji komórek jednojądrzastych, których odpowiednią liczbę używamy dalej do stymulacji. Test T-SPOT.COVID zoptymalizowany jest zarówno pod kątem liczby komórek, jak i warunków hodowli. Dzięki temu test ten można z powodzeniem stosować u osób z niedoborami odporności, co zostało wskazane w rekomendacjach francuskiej Grupy do spraw Infekcji i Immunosupresji.
Mówiąc najprościej, test Quan-T-Cell bada globalną odpowiedź limfocytów na stymulację antygenem wirusa SARS-CoV-2, a wydzielany interferon gamma jest precyzyjnie mierzony testem ELISA, dzięki czemu otrzymujemy wynik ilościowy. Natomiast test T-SPOT.COVID bada, jak wiele spośród limfocytów T wydziela interferon gamma w odpowiedzi na stymulację antygenami wirusa.
Dlaczego warto badać odpowiedź komórkową w COVID-19?
Badanie odporności, nabytej w wyniku przebycia naturalnej infekcji lub w wyniku szczepienia, kojarzy się przede wszystkim z badaniem specyficznych przeciwciał, ale należy pamiętać, że ocena wyłącznie odpowiedzi humoralnej ma pewne ograniczenia.
Przeprowadzone do tej pory badania wskazują, że analiza odpowiedzi komórkowej może stanowić dodatkowe narzędzie umożliwiające ocenę długotrwałej odpowiedzi immunologicznej na SARS-CoV-2, w tym również odpowiedzi poszczepiennej. Dlaczego i u kogo warto będzie badać odpowiedź komórkową? Uważa się, że długo utrzymujące się limfocyty T są związane z silną ochroną immunologiczną, nawet przy braku detekcji przeciwciał. Jest to istotne, ponieważ, jak już wiemy, z czasem przeciwciała klasy IgG zanikają. Czy na pewno wiąże się to z utratą odporności? Tego jeszcze dokładnie nie wiemy. Ponadto u części pacjentów w ogóle nie dochodzi do produkcji specyficznych przeciwciał. W tym przypadku przebyte zakażenie lub odpowiedź na szczepienie można wykryć jedynie poprzez ocenę odpowiedzi komórkowej. Dlatego też uważa się, że w badaniach nad potencjalną odpornością na COVID-19 istotne jest kompleksowe podejście do oceny odpowiedzi układu immunologicznego i wzięcie pod uwagę zarówno odpowiedzi humoralnej, jak i komórkowej.

Patryk Matuszek
Ekspert ds. Szkoleń i Wystąpień Publicznych, Senior Product Manager ds. Boreliozy





Dodaj komentarz