Przeciwciała anty-PLA2R są uważane za bardzo wiarygodny marker diagnostyczny pierwotnego błoniastego kłębuszkowego zapalenia nerek i stanowią ważne kryterium wpływające na decyzję o wykonaniu bądź pominięciu biopsji nerki w procesie diagnostycznym. Na tym jednak znaczenie przeciwciał anty-PLA2R się nie kończy. Są cennym narzędziem w monitorowaniu aktywności choroby i skuteczności terapii oraz w ocenie możliwości nawrotu schorzenia po transplantacji nerki.
Przeciwciała anty-PLA2R w monitorowaniu aktywności choroby
Autoprzeciwciała anty-PLA2R (przeciwko receptorowi 1 fosfolipazy A2 podocytów) mogą dostarczyć ważnych informacji na temat aktywności klinicznej pierwotnej postaci błoniastego kłębuszkowego zapalenia nerek (pMN, ang. primary membranous nephropathy). Badania wykazały, że przebieg choroby i powodzenie terapii u pacjentów z pMN można ocenić poprzez monitorowanie poziomu przeciwciał anty-PLA2R. Na przykład u osób z ostrym zespołem nefrotycznym (wysoki białkomocz) obserwowano wysokie miana przeciwciał przeciwko PLA2R. Wraz ze spontaniczną remisją lub remisją spowodowaną leczeniem (niski białkomocz) miana tych przeciwciał spadały poniżej granicy wykrywalności. U chorych z początkowo wysokimi mianami przeciwciał spontaniczna remisja występowała znacznie rzadziej niż u pacjentów z niskimi mianami przeciwciał zmierzonymi na początku choroby. Co ciekawe, nawrót pMN poprzedzony był wzrostem poziomu przeciwciał. Na podstawie tych obserwacji sformułowano wniosek, że fazy remisji klinicznej i nawrotów można przewidzieć m.in. dzięki monitorowaniu stężenia przeciwciał przeciwko PLA2R [1, 2].
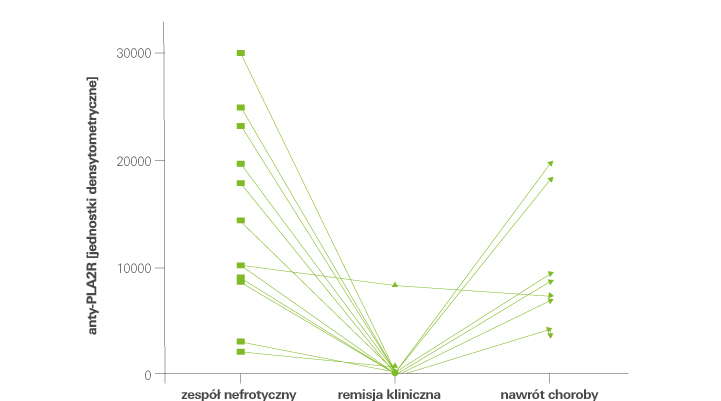
Rys. 1. Poziom autoprzeciwciał anty-PLA2R a przebieg kliniczny. Opracowano i zmodyfikowano na podstawie: Hofstra J.M. et al. Anti-phospholipase A2 receptor antibodies correlate with clinical status in idiopathic membranous nephropathy. Clinical Journal of the American Society of Nephrology 2011; 6(6): 1286–1291.
Przeciwciała anty-PLA2R markerem prognostycznym przebiegu nefropatii błoniastej
Ponieważ spontaniczna remisja jest stosunkowo powszechna w nefropatii błoniastej, a leczenie immunosupresyjne może nieść ze sobą skutki uboczne, ważne jest, aby prawidłowo ocenić ryzyko postępującej utraty czynność nerek przed podjęciem decyzji o tym, czy i kiedy należy wdrożyć u pacjenta leczenie immunosupresyjne. W nowych rekomendacjach Kidney Disease: Improving Global Outcomes (KDIGO) z 2021 r. pojawia się zalecenie, by u osób z nefropatią błoniastą zastosować kryteria kliniczne i laboratoryjne do oceny ryzyka postępującej utraty czynności nerek [3]. W zaleceniach przedstawiono tabelę, w której skorelowane jest ryzyko postępującej utraty czynności nerek z kryteriami kliniczno-laboratoryjnymi.
| Niskie ryzyko | Średnie ryzyko | Wysokie ryzyko | Bardzo wysokie ryzyko |
| eGFR w normie, białkomocz < 3,5 g/d i albumina w surowicy 30 g/l LUB |
eGFR w normie, białkomocz > 3,5 g/d i brak spadku wartości o > 50% po 6 miesiącach terapii zachowawczej z zastosowaniem ACEi/ARB ORAZ |
eGFR < 60 ml/min/1,73 m2 i/lub białkomocz > 8 g/d utrzymujący się powyżej 6 miesięcy LUB |
zagrażający życiu zespół nerczycowy LUB |
| eGFR w normie, białkomocz < 3,5 g/d lub spadek wartości o > 50% po 6 miesiącach terapii zachowawczej z zastosowaniem ACEi/ARB | niespełnienie kryteriów wysokiego ryzyka | eGFR w normie, białkomocz > 3,5 g/d i brak spadku wartości o > 50% po 6 miesiącach terapii zachowawczej z zastosowaniem ACEi/ARB oraz spełnienie przynajmniej jednego kryterium z wymienionych poniżej:albumina <25 g/l przeciwciała anty-PLA2R >50 RU/ml alfa-1-mikroglobulina w moczu >40 µg/min IgG w moczu >1 µg/min beta-2-mikroglobulina w moczu >250 mg/d wskaźnik selektywności >0,20 |
gwałtowne pogorszenie funkcji nerek, niewyjaśnione w inny sposób |
eGFR (ang. estimated glomerular filtration rate) – wskaźnik filtracji kłębuszkowej
ACEi (ang. angiotensin-converting-enzyme inhibitors) – inhibitory konwertazy angiotensyny
ARB (ang. angiotensin II receptor blockers) – antagoniści receptora angiotensyny II
Monitorowanie terapii za pomocą badania stężenia przeciwciał anty-PLA2R
Poziom przeciwciał anty-PLA2R można również wykorzystać do oceny odpowiedzi pacjenta na stosowaną terapię. U osób, które skutecznie reagują na leczenie, miano anty-PLA2R się obniża. W przypadku nawrotu choroby – ponownie wzrasta [4, 5]. Ponadto rozpoznano wysokie miano anty-PLA2R jako czynnik ryzyka u pacjentów, którzy nie osiągnęli remisji białkomoczu w wyniku leczenia. Laurence Beck i współpracownicy wykazali, że odpowiedź immunologiczna na terapię jest znacznie szybsza niż odpowiedź kliniczna [4]. U osób reagujących na leczenie immunosupresyjne miano anty-PLA2R zmniejszyło się na kilka miesięcy przed spadkiem białkomoczu [4]. Elion Hoxha i współpracownicy doszli do tego samego wniosku. Stwierdzili 81-procentową redukcję miana anty-PLA2R u badanych pacjentów w ciągu 3 miesięcy po rozpoczęciu leczenia immunosupresyjnego [5]. W tym samym czasie białkomocz zmniejszył się o około 39%. Pomimo oczywistego związku miano anty-PLA2R jako marker immunologiczny powinno być monitorowane obok białkomoczu, który pełni rolę markera klinicznego. Na podstawie znanego dotychczas porządku chronologicznego tych zdarzeń w patogenezie pMN należy przyjąć, że markery te reagują podobnie w przebiegu choroby, ale z przesunięciem czasowym [6, 7].
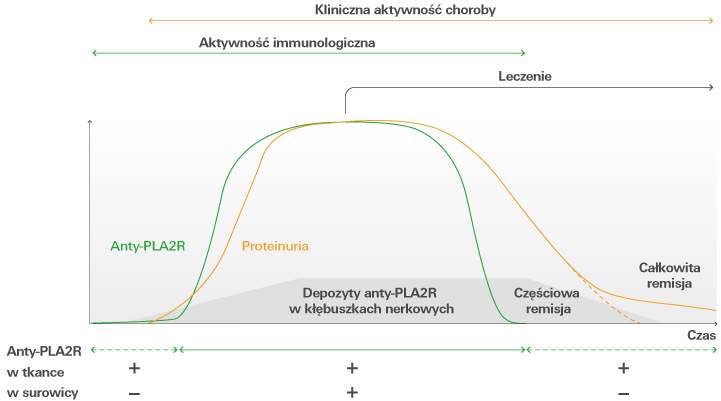
Rys. 2. Zmodyfikowana ilustracja z: Francis J.M., Beck Jr L.H., Salant D.J. Membranous nephropathy: a journey from bench to bedside. American Journal of Kidney Diseases 2016; 68(1): 138–147.
Potwierdzeniem zauważalnej korelacji pomiędzy poziomem przeciwciał anty-PLA2R a sukcesem leczenia są zalecenia KDIGO. Długofalowe monitorowanie poziomu przeciwciał anty-PLA2R może być przydatne do oceny odpowiedzi na leczenie u pacjentów z nefropatią błoniastą i pomóc w podjęciu decyzji o dalszym sposobie prowadzenia terapii [3].

Rys. 3. Monitorowanie aktywności choroby u pacjentów z nefropatią błoniastą związaną z anty-PLA2R.
Podsumowanie
Monitorowanie przeciwciał anty-PLA2R:
- dostarcza informacji o aktywności i możliwej progresji choroby
- pozwala przewidzieć fazy remisji klinicznej i nawrotów choroby
- jest przydatne przy podejmowaniu decyzji dotyczących terapii.
Piśmiennictwo
- Hofstra J.M. et al. Anti-phospholipase A2 receptor antibodies correlate with clinical status in idiopathic membranous nephropathy. Clinical Journal of the American Society of Nephrology 2011; 6(6): 1286–1291.
- Hofstra J.M. et al. Antiphospholipase A2 receptor antibody titer and subclass in idiopathic membranous nephropathy. Journal of the American Society of Nephrology 2012; 23(10): 1735–1743.
- Rovin B.H. et al. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney International 2021; 100(4): S1–S276.
- Beck L.H. et al. Rituximab-induced depletion of anti-PLA2R autoantibodies predicts response in membranous nephropathy. Journal of the American Society of Nephrology 2011; 22(8): 1543–1550.
- Hoxha E. et al. Phospholipase A2 receptor autoantibodies and clinical outcome in patients with primary membranous nephropathy. Journal of the American Society of Nephrology 2014; 25(6): 1357–1366.
- Beck Jr L.H., Salant D.J. Membranous nephropathy: recent travels and new roads ahead. Kidney International 2010; 77(9): 765–770.
- Francis J.M., Beck Jr L.H., Salant D.J. Membranous nephropathy: a journey from bench to bedside. American Journal of Kidney Diseases 2016; 68(1): 138–147.

Katarzyna Buska-Mach
Kierownik Działu Promocji Produktów i Szkoleń Stacjonarnych, Senior Product Manager ds. Neurologii i TORCH 10





Dodaj komentarz