Wstęp
Autoimmunologiczne zapalenie wątroby (AIH – autoimmune hepatitis) jest przewlekłą, zapalną chorobą miąższu wątroby, która nieleczona prowadzi do destrukcji wątroby i w konsekwencji do jej marskości. Po raz pierwszy AIH zostało opisane przez prof. Jana Waldenströma w 1950 roku. Choroba zaobserwowana w grupie młodych kobiet została opisana wówczas jako ciężka postać zapalenia wątroby ze znacznym wzrostem immunoglobulin w surowicy. Następnie zauważono, że u pacjentów z podobną kohortą obecne były komórki LE (LE cells – lupus erythematosus cells) oraz przeciwciała przeciwjądrowe (ANA). Obserwacje te doprowadziły do postawienia hipotezy, że przyczyną dolegliwości pacjentów była utrata tolerancji immunologicznej. W dalszej kolejności potwierdzono autoimmunizacyjny charakter choroby, w przebiegu której w surowicy pacjentów pojawiają się charakterystyczne autoprzeciwciała. AIH występuje znacznie częściej u kobiet niż u mężczyzn.
Obecnie wyróżnia się trzy typy AIH:
- AIH typu 1 z obecnymi przeciwciałami ANA, ASMA, anty-SLA/LP
- AIH typu 2 z obecnymi przeciwciałami anty-LKM, anty-LC1
- kryptogenne zapalenie wątroby bez obecności autoprzeciwciał
Kryteria rozpoznania autoimmunologicznego zapalenia wątroby
Kryteria rozpoznania AIH zakładają:
- podwyższone stężenie transaminaz oraz IgG w surowicy pacjenta
- obecność w surowicy pacjenta specyficznych dla AIH autoprzeciwciał
- stwierdzenie charakterystycznych zmian histopatologicznych w bioptacie wątroby
- diagnostykę różnicową i wykluczenie innych przyczyn dolegliwości pacjenta
Na tej podstawie zaproponowano punktowy system diagnostyczny:
| Parametr | Cecha | Punkty |
| Płeć | kobieta | 2 |
ALP : AST (lub ALT) ratio |
>3 | –2 |
| 1,5–3 | 0 | |
| <1,5 | 2 | |
Immunoglubuliny surowicze lub IgG (x ponad normę) |
>2,0 | 3 |
| 1,5–2,0 | 2 | |
| 1,0–1,5 | 1 | |
| <1,0 | 0 | |
ANA, ASMA lub anty-LKM1 (miano) |
>1:80 | 3 |
| 1:80 | 2 | |
| 1:40 | 1 | |
| <1:40 | 0 | |
| AMA | obecne | –4 |
| Inne autoprzeciwciała | anty-SLA/LP, anty-aktyna, ASGPR, pANCA | 2 |
| Markery wirusowe | obecne | –3 |
| nieobecne | 3 | |
| Stosowanie leków hepatotoksycznych | TAK | –4 |
| NIE | 2 | |
| Spożywanie alkoholu | <25 g/dzień | 2 |
| >60 gr/dzień | –2 | |
| Zmiany histopatologiczne | martwica kęsowa | 3 |
| komórki plazmatyczne | 1 | |
| rozety | 1 | |
| żadne z powyższych | –5 | |
| Choroby autoimmunologiczne | autoimmunologiczne zapalenie tarczycy, wrzodziejące zapalenie wątroby, inne | 2 |
| HLA | DR3 lub DR4 | 1 |
| Odpowiedź na leczenie | remisja | 2 |
| wznowa | 3 |
Tabela 1. Kryteria rozpoznania AIH wg „International autoimmune hepatitis group”. F. Alvarez, P.A. Berg et al. J Hepatol 1999; 31: 929–938.
Ocena przed leczeniem: >15 pkt. – rozpoznanie pewne, 10–15 pkt. – rozpoznanie prawdopodobne
Ocena po leczeniu: >17 pkt. – rozpoznanie pewne, 12–17 pkt. – rozpoznanie prawdopodobne
Pojęcia: ALP – fosfataza alkaiczna, AST – aminotransferaza asparaginianowa, ALT – aminotransferaza alaninowa, IgG – immunoglobulina G, ANA – przeciwciała przeciwjądrowe, ASMA – przeciwciała przeciwko mięśniom gładkim, anty-LKM1 – przeciwciała przeciwko mikrosomom nerkowo-wątrobowym typu 1, AMA – przeciwciała przeciwko mitochondriom, anty-SLA/LP – przeciwciała przeciwko rozpuszczalnym antygenom wątrobowym lub wątrobowo-trzustkowym, ASGPR – przeciwciała przeciwko receptorowi asialoglikoproteinowemu, pANCA – przeciwciała przeciwko cytoplazmie neutrofilów o typie fluorescencji perinuklearnym, HLA – ludzkie antygeny leukocytarne
Rola autoprzeciwciał w diagnostyce autoimmunologicznego zapalenia wątroby
Autoprzeciwciała odgrywają kluczową rolę w diagnostyce i monitorowaniu aktywności autoimmunologicznego zapalenia wątroby. Powinny być oznaczone możliwie jak najwcześniej przy pierwszym podejrzeniu choroby. Stanowią również kryterium różnicujące pomiędzy AIH typu 1 oraz 2. Najczęściej wykrywanymi autoprzeciwciałami są ANA, ASMA dla typu 1 oraz anty-LKM1, anty-LC1 dla typu 2. W związku z dążeniem do podniesienia trafności diagnostycznej nadal trwają poszukiwania kolejnych przeciwciał markerowych. Wśród znanych autoprzeciwciał występujących w przebiegu AIH wymienić można dodatkowo przeciwciała przeciwko aktynie, przeciwciała przeciwko receptorowi asialoglikoproteinowemu (anty-ASGPR) oraz przeciwciała przeciwko rozpuszczalnym antygenom wątrobowym lub wątrobowo-trzustkowym (anty-SLA/LP). Te ostatnie przypisuje się do AIH typu 1.
Przeciwciała anty-SLA/LP
Przeciwciała anty-SLA oraz anty-LP traktowane były początkowo jako dwie odrębne grupy autoprzeciwciał. Obecnie wiadomo, że stanowią one jedną frakcję immunoglobulin określanych jako anty-SLA/LP. Antygenem docelowym jest białko związane z supresorowym UGA-tRNA.
Do niedawna jedyną metodą oznaczania przeciwciał anty-SLA/LP były testy monospecyficzne, takie jak ELISA lub Blot. Przeciwciała te nie są bowiem możliwe do wykrycia za pomocą klasycznych testów immunofluorescencji pośredniej (IIFT) z wykorzystaniem skrawków tkanek zwierzęcych. Stanowi to istotny problem w serologicznej diagnostyce przesiewowej AIH.
Rozwój metod biologii molekularnej zaowocował wprowadzeniem testów typu CBA (CBA – cell based assay), w których zastosowano biochip oparty o komórki transfekowane antygenem SLA/LP. Wzbogacone w ten sposób mozaiki IIFT mają możliwość wykrycia przeciwciał anty-SLA/LP, co znacząco podniosło czułość diagnostyczną na etapie badania skriningowego.
Początkowo zauważono, że przeciwciała anty-SLA/LP wykrywane są w surowicy pacjentów seronegatywnych pod kątem innych autoprzeciwciał. Z tego powodu stanowiły one kryterium rozpoznania AIH typu 3. Obecnie włączone są do typu 1. Przeciwciała anty-SLA/LP mogą występować również u pacjentów HCV pozytywnych z przeciwciałami anty-LKM1, co podkreśla ich ważną rolę w różnicowaniu AIH z zakażeniem wirusowym. Współistnienie przeciwciał anty-LKM1 z anty-SLA/SP może być wynikiem zespołu nakładania HCV z AIH typu 1, co wiąże się z gorszym rokowaniem dla pacjenta.
Testy IIFT do oznaczania przeciwciał anty-SLA/LP
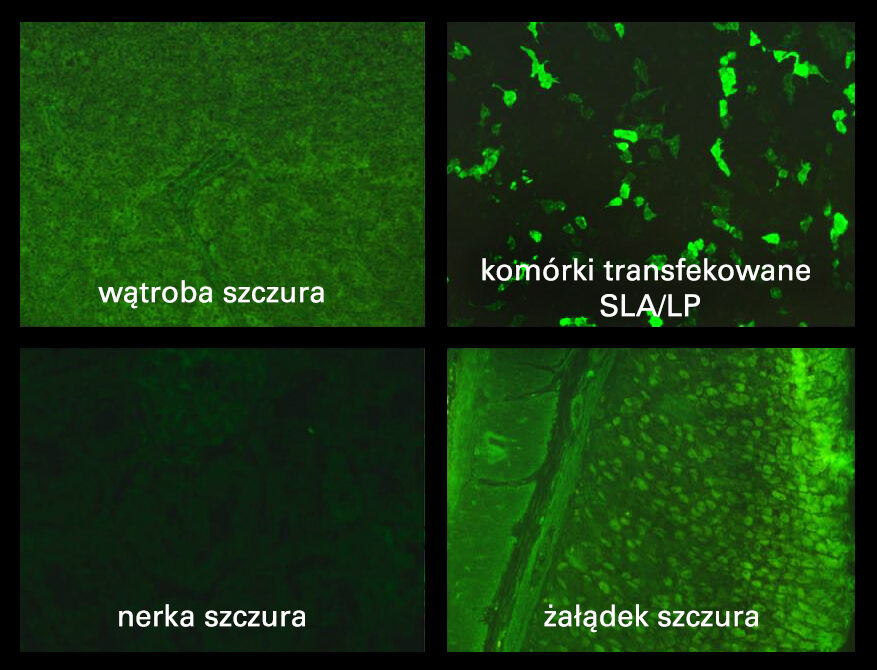
Do niedawna detekcja przeciwciał anty-SLA/LP możliwa była wyłącznie metodami monospecyficznymi (ELISA, Blot). Obecnie można je wykryć również za pomocą testów IIFT z zastosowaniem komórek transfekowanych. Dostępne są dwa rozwiązania:
- Mozaika „Liver screen 1”, w skład której wchodzą: nerka szczura, żołądek szczura, wątroba szczura, komórki transfekowane SLA/LP. Stanowi ona optymalną kombinację umożliwiającą jednoczesną ocenę przeciwciał AMA, ASMA, LKM, SLA/LP
- Test oparty wyłącznie o komórki transfekowane SLA/LP

Patryk Matuszek
Ekspert ds. Szkoleń i Wystąpień Publicznych, Senior Product Manager ds. Boreliozy





Dodaj komentarz